

主動脈夾層(aortic dissection,AD)是指由于各種原因導致的主動脈內膜、中膜撕裂,血液通過主動脈內膜裂口進入主動脈壁,造成動脈壁的分離,同時血流逆行或順行沖擊導致主動脈壁間血腫蔓延,使得主動脈被分割為真腔和假腔,并通過一個或數個破口與主動脈原有正常管腔相交通,從而形成“夾層”1。
AD是最常見的主動脈疾病之一。AD發病與季節存在相關性,冬春季節發病率較高,夏季發病率較低。我國AD發病率約為2.8/10萬人年,男性明顯高于女性(3.7/10萬 人年vs 1.5/10萬人年)。Sino-RAD研究顯示我國AD患者平均年齡51歲,比歐美國家相比平均年輕10歲以上,血壓控制不理想可能是我國AD發病較早的重要原因。近年來我國AD患病率呈現上升趨勢2-4。
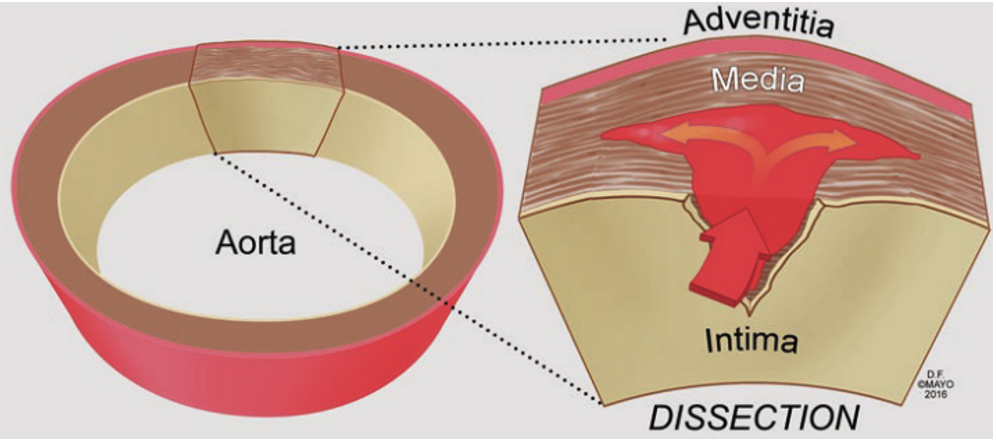
圖示:典型主動脈夾層形成機制5
AD起病兇險,典型癥狀為前胸、后背或腹部突發性劇烈的撕裂樣或刀割樣銳痛,疼痛持續難以忍受。疼痛可沿大動脈走行方向傳導和轉移至腹部或下腹部。 88.1%的AD患者有疼痛癥狀,70.3%的患者為突發疼痛。隨病程進展,患者還可出現與主動脈破裂、主動脈瓣關閉不全、重要組織臟器缺血相關的癥狀和體征。AD引起患者死亡的主要原因是主動脈破裂、急性心包壓塞、急性心肌梗死、卒中、腹腔臟器缺血、肢體缺血等。未經治療的急性夾層6小時內死亡率超過22.7%,24小時內超過50%,一周內超過68%。未經手術治療的急性Stanford A型AD發病24 h內病死率每小時增加1%~2%,發病1周病死率超過70%。即使是慢性AD仍存在主動脈破裂、臟器衰竭等死亡風險1, 3。
內膜撕裂起源于升主動脈(承受應力最大處)者占65% ,起于降主動脈者占 25%,起于主動脈弓和腹主動脈的占 10%。根據內膜撕裂的位置和夾層沿主動脈延展的范圍可對主動脈夾層進行解剖分型,主要有DeBakey分型和Stanford分型兩種。DeBakey分型分為3型:I型夾層起于升主動脈,并累及主動脈弓,延伸至胸降主動脈或腹主動脈;II型夾層起于并局限于升主動脈;III a型夾層起于并局限于胸降主動脈; IIIb型夾層累及胸降主動脈和腹主動脈。 Stanford分型簡化了解剖分類標準,只依據第一破口的起始部位來分類:Stanford A型夾層起于升主動脈,因此包括DeBakey I型和II型夾層;Stanford B型夾層起于左鎖骨下以遠的降主動脈,包括DeBakey IIIa型和IIIb型1, 3。
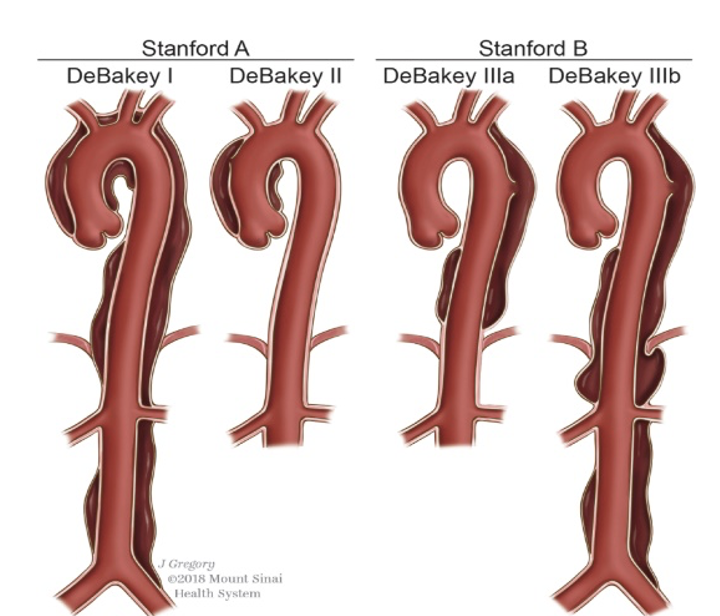
圖示:主動脈夾層的DeBakey分型與Standford分型對照6
主動脈瘤(aortic aneurysm)是指由于各種原因造成胸主動脈壁正常結構的損害,在血流壓力的作用下,主動脈局部或彌漫性擴張或膨出,達到正常主動脈直徑的1.5倍以上,即成為主動脈瘤。特別的,腹主動脈直徑超過30mm即可診斷為腹主動脈瘤。胸主動脈瘤發病率約為5~10/萬人年,腹主動脈瘤發病率約為50/萬人年7, 8。
大多數主動脈瘤患者沒有明顯癥狀。對于有明顯臨床癥狀的患者,胸部、腹部疼痛是最常見的主訴。其他非特異性的臨床癥狀多由瘤體壓迫、牽拉、侵蝕周圍組織所引起。當主動脈瘤破裂時,出血速度和出血量非常大,可出現急性胸痛、腹痛、休克等癥狀和體征,死亡率高達90%1, 9, 10。
根據動脈瘤累及部位不同,可將主動脈瘤分為胸主動脈瘤(thoracic aortic aneurysm, TAA)、腹主動脈瘤(abdominal aortic aneurysm,AAA)和胸腹主動脈瘤(thoracoabdominal aortic aneurysm, TAAA):
TAA可根據動脈瘤位置大致劃分為主動脈根部瘤、升主動脈瘤、主動脈弓瘤和降胸主動脈瘤,而降主動脈瘤以第6肋為界又可進一步分為A、B、C三型11, 12;

圖示:胸主動脈瘤分型11
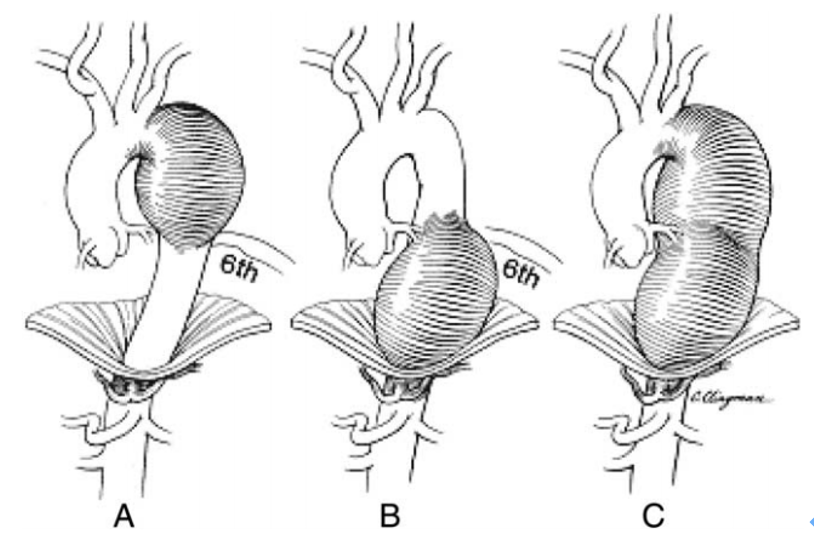
圖示:降胸主動脈瘤分型12
AAA根據瘤體與腎動脈和內臟動脈的解剖關系可分為腎動脈下型、近腎動脈型、腎動脈累及型和腹腔干累及型13;
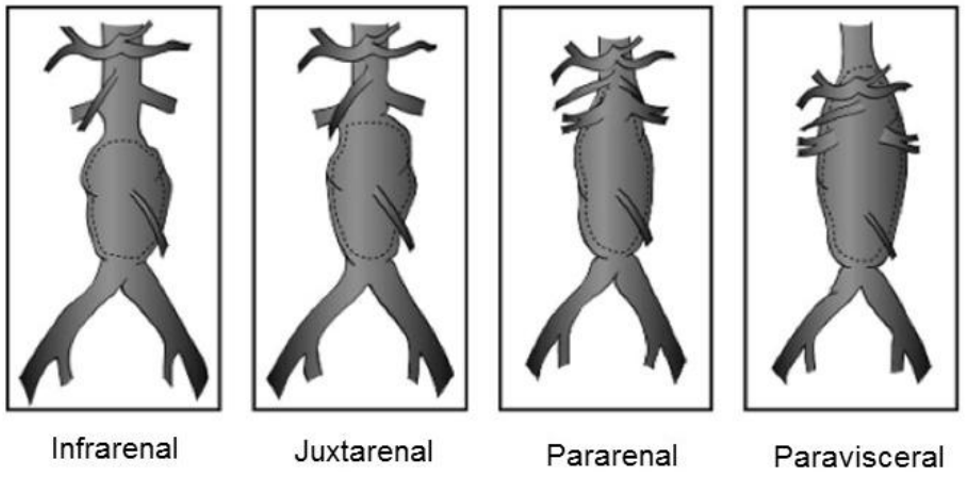
圖示:腹主動脈瘤分型13
TAAA的改良Crawford分型共有5型,I型瘤體位于左鎖骨下動脈與腹腔干之間(即降主動脈瘤),II型上界位于左鎖骨下動脈與第六肋間之間、下界超過腎動脈平面,III型上界低于第六肋間、下界超過腎動脈平面,IV型累計腹主動脈全程,V型位于第六肋間與腎動脈平面之間14。
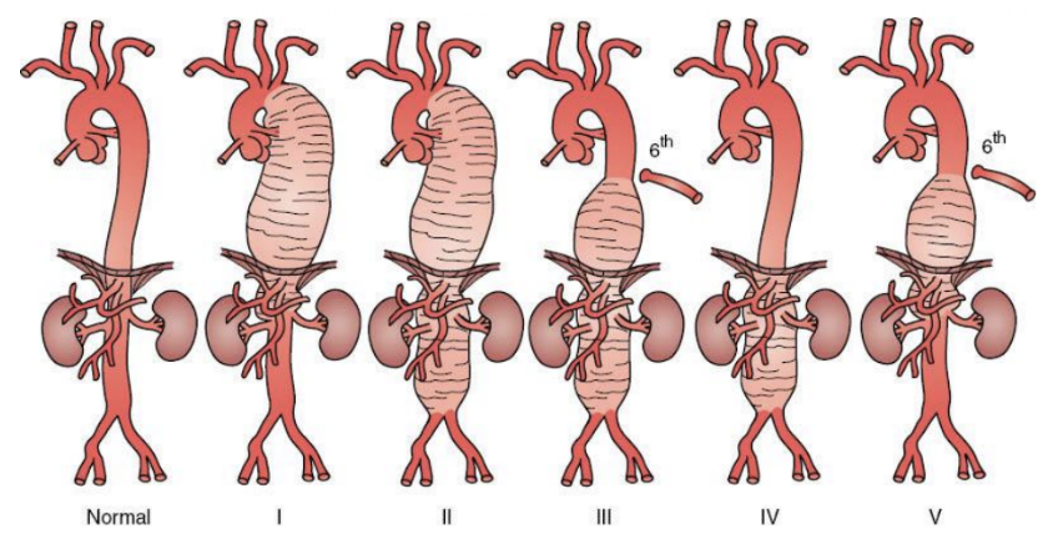
圖示:胸腹主動脈瘤的Safi改良Crawford分型13
需要注意的是,胸主動脈瘤和腹主動脈瘤實際上是一組密切相關的疾病,27%的腹主動脈瘤患者同時患有胸主動脈瘤10。
主動脈腔內修復(endovascular aortic repair,EVAR)起源于上世紀90年代,其原理是經過股動脈,將覆膜支架輸送到主動脈病變處,以隔絕動脈瘤瘤體或隔絕主動脈夾層的破口同時擴張真腔壓迫假腔,從而防止疾病進展4。隨著技術創新和產品迭代,EVAR已經成為主動脈疾病的重要治療措施。與傳統外科手術相比,EVAR具有創傷小 、成功率高、恢復快,并發癥少等優點。
主動脈腔內修復常用于Stanford B型夾層、降胸主動脈瘤、解剖結構合適的腹主動脈瘤、主動脈壁間血腫、主動脈穿通性潰瘍、主動脈創傷、主動脈包裹性破裂、主動脈假性動脈瘤和主動脈醫源性夾層等。ESC指南對伴有并發癥和不伴并發癥的Stanford B型夾層腔內修復推薦等級分別為I C和IIa B;對于降胸主動脈瘤,腔內修復的推薦等級IIa C;對于解剖結構適宜的腹主動脈瘤,腔內修復推薦等級為I A10。目前我國Stanford B型夾層EVAR治療率已達69.6%,手術成功率高達99.1%,且死亡率僅為2.5%,明顯低于外科手術治療(8.0%)和單純藥物治療(9.8%)15, 16。
然而,對于Stanford A型夾層全腔內修復、主動脈根部和弓部胸主動脈瘤、廣泛累及內臟動脈、髂分支的腹主動脈瘤,現有EVAR器械和技術仍有很大提升空間,其中存在巨大的未滿足臨床需求。
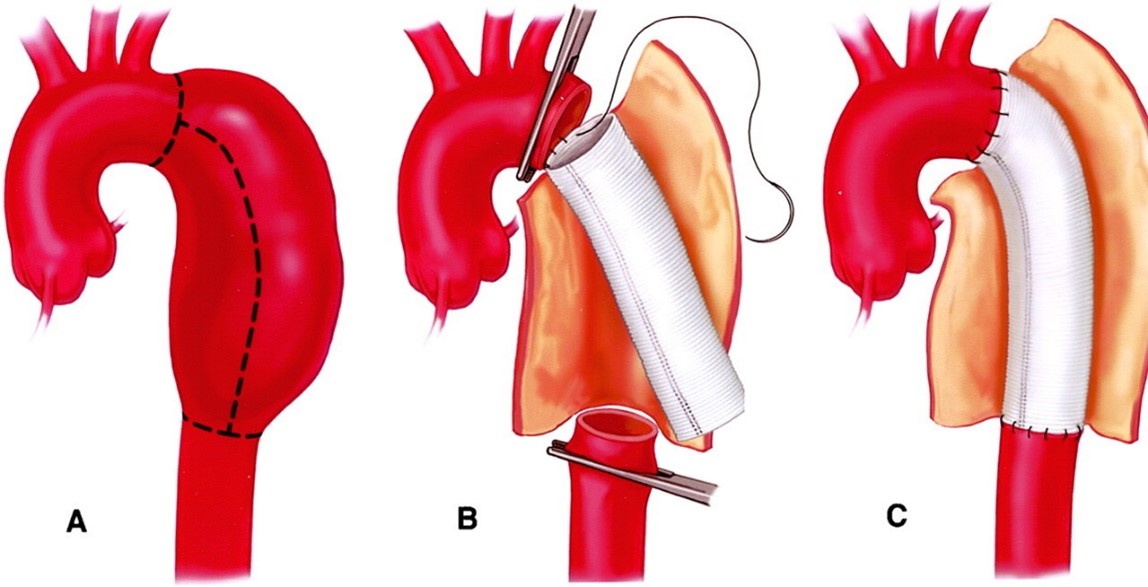
圖示:主動脈外科手術示意圖(以降胸主動脈瘤為例)17
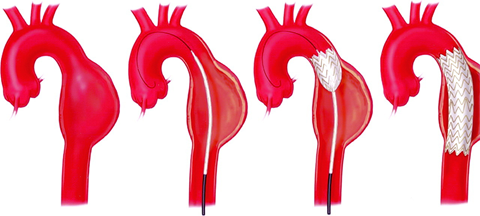
圖示:EVAR示意圖(以降胸主動脈瘤為例)17
下肢動脈疾病(lower extremity arterial disease,LEAD)屬于外周動脈疾病(Peripheral arterial)PAD中的一種。廣義的LEAD應包括全部引起下肢動脈病變、引起下肢血流障礙的疾病,病因可包括下肢動脈瘤、下肢動脈栓塞、下肢動脈血栓閉塞性脈管炎、動脈囊性外膜病和下肢動脈硬化閉塞等。狹義的LEAD僅指下肢動脈硬化性閉塞(arteriosclerosis obliterans, ASO)引起的下肢動脈疾病18。我國≥ 35 歲的自然人群LEAD患病率為 6.6%,患病率隨年齡增長而上升,70 歲以上人群的患病率在 15%~20%。男性發病率略高于女性。推測我國下肢動脈疾病患者約為4530萬。我國下肢動脈疾病的主要危險因素有吸煙、高血壓、高膽固醇血癥和 2 型糖尿病等,其中吸煙與LEAD相關性最強,吸煙者患病風險約為正常人的2.6倍19。不同危險因素對應的LEAD病變好發部位存在差異20。
LEAD的典型病理改變是動脈粥樣硬化斑塊形成、內膜及中層增生、動脈硬化,繼而使得動脈管腔狹窄甚至閉塞,導致遠端肢體血供不足,如不經治療,5~10%的患者5年內可進展為(Critical limb ischemia,CLI)21。CLI患者仍不及時治療,1年截肢率高達22%21。
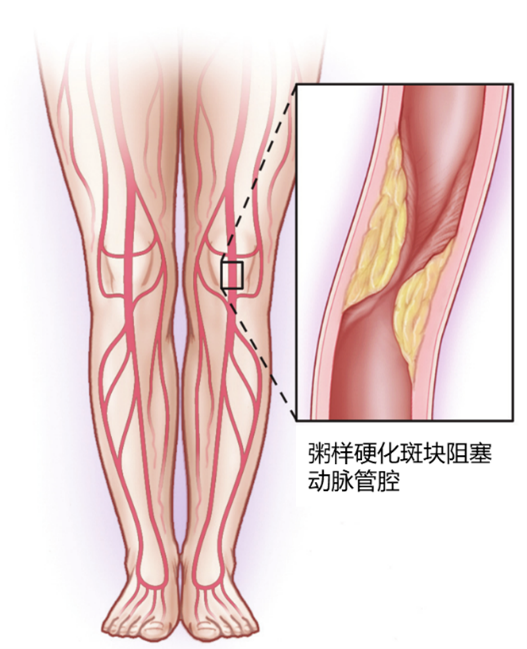
圖示:動脈管腔狹窄23
LEAD臨床表現多樣。典型臨床表現為間歇性跛行和靜息痛,典型體征主要有肢端皮溫下降、皮膚菲薄、毛發脫落 等營養障礙性改變,下肢動脈搏動減弱或消失,動脈收縮壓下降,肢體潰瘍、壞疽等。其中,間歇性跛行是指一種由運動誘發的癥狀,指下肢運動后產生的疲乏、疼痛或痙攣,常發生在小腿后方,導致行走受限,短時間休息后(常少于10 min)疼痛和不適感可緩解;再次運動后癥狀又出現。跛行距離可以提示缺血的程度;靜息痛是指患肢即使不運動,在靜息狀態下也可出現的持續性疼痛,是LEAD引起肢體嚴重缺血的主要臨床表現之一,預示肢體存在近期缺血壞死風險24。
LEAD是全身動脈硬化的一種表征,因此生活方式干預和藥物治療是LEAD治療的基礎。生活方式干預主要包括戒煙、健康飲食和監督運動療法。藥物治療方案主要涵蓋高脂血癥、高血壓、糖尿病等基礎疾病的藥物治療以及抗血小板、抗凝藥物治療,此外β受體抑制劑、鈣離子通道抑制劑、PDE III抑制劑、前列腺素、5-HT2受體拮抗劑可改善運動功能和間歇性跛行癥狀。
當藥物治療無法改善患者癥狀和運動功能時,需要選擇下肢動脈血運重建治療。我國約 1.9%的患者接受了血運重建,據此估測實施血運重建的例數大約為 86 萬。血運重建治療主要可分為介入治療和外科手術治療兩種方式。介入治療因其良好的安全性和有效性逐漸成為LEAD的主流治療方式。對于動脈病變范圍<5cm的主-髂動脈LEAD、<25cm的股-腘動脈LEAD,介入治療是首選的血運重建治療方式18, 24, 25。
LEAD介入治療方式包括球囊成型、支架植入、斑塊切除、切割球囊、藥涂球囊、冷凍球囊、導管溶栓和機械取栓等。目前,支架植入和球囊擴張成形是治療下肢動脈狹窄的主要介入治療方式。隨著新技術的涌現,LEAD介入治療率有望持續提高。
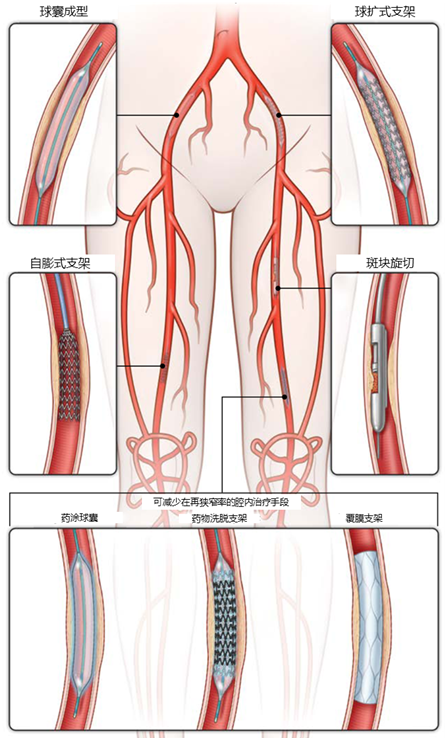
圖示:LEAD介入治療示意圖26
參考文獻:
1. 趙宗繼陳孝平汪建平. 外科學(第9版): 人民衛生出版社; 2018.
2. 胡盛壽. 中國心血管健康與疾病報告2019: 科學出版社; 2020.
3. 中國醫師協會心血管外科分會大血管外科專業委員會. 主動脈夾層診斷與治療規范中國專家共識. 中華胸心血管外科雜志 2017;33:641-54.
4. 中國醫師協會心血管外科分會大血管外科專業委員會. 急性主動脈綜合征診斷與治療規范中國專家共識(2021版). 中華胸心血管外科雜志 2021;37:257-69.
5. Oderich GS. Endovascular Aortic Repair: Springer; 2017.
6. Tadros RO, Tang GHL, Barnes HJ, et al. Optimal Treatment of Uncomplicated Type B Aortic Dissection JACC Review Topic of the Week. J AM COLL CARDIOL 2019;74:1494-504.
7. Zommorodi S, Leander K, Roy J, Steuer J, Hultgren R. Understanding abdominal aortic aneurysm epidemiology: socioeconomic position affects outcome. J Epidemiol Community Health 2018;72:904-10.
8. Bossone E, Eagle KA. Epidemiology and management of aortic disease: aortic aneurysms and acute aortic syndromes. NAT REV CARDIOL 2021;18:331-48.
9. 中華醫學會外科學分會血管外科學組. 腹主動脈瘤診斷與治療指南. 中國實用外科雜志 2008;28:916-8.
10. Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). EUR HEART J 2014;35:2873-926.
11. Disease. SGSI. AORTIC ANEURYSM. In.
12. Estrera AL, Rubenstein FS, Miller CR, Huynh TT, Letsou GV, Safi HJ. Descending thoracic aortic aneurysm: surgical approach and treatment using the adjuncts cerebrospinal fluid drainage and distal aortic perfusion. ANN THORAC SURG 2001;72:481-6.
13. Calero A, Illig KA. Overview of aortic aneurysm management in the endovascular era. SEMIN VASC SURG 2016;29:3-17.
14. Safi HJ, Winnerkvist A, Miller CR, et al. Effect of extended cross-clamp time during thoracoabdominal aortic aneurysm repair. ANN THORAC SURG 1998;66:1204-9.
15. Xiong J, Chen C, Wu Z, Chen D, Guo W. Recent evolution in use and effectiveness in mainland China of thoracic endovascular aortic repair of type B aortic dissection. Sci Rep 2017;7:17350.
16. Wang W, Duan W, Xue Y, et al. Clinical features of acute aortic dissection from the Registry of Aortic Dissection in China. J Thorac Cardiovasc Surg 2014;148:2995-3000.
17. Isselbacher EM. Thoracic and abdominal aortic aneurysms. CIRCULATION 2005;111:816-28.
18. Aboyans V, Ricco J, Bartelink MEL, et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). EUR HEART J 2018;39:763.
19. 胡盛壽. 中國心血管健康與疾病報告2019: 科學出版社; 2020.
20. Diehm N, Shang A, Silvestro A, et al. Association of cardiovascular risk factors with pattern of lower limb atherosclerosis in 2659 patients undergoing angioplasty. EUR J VASC ENDOVASC 2006;31:59-63.
21. Norgren L, Hiatt WR, Dormandy JA, et al. Inter-society consensus for the management of peripheral arterial disease (TASC II). J VASC SURG 2007;45S:S5-67.
22. Abu Dabrh AM, Steffen MW, Undavalli C, et al. The natural history of untreated severe or critical limb ischemia. J VASC SURG 2015;62:1642.
23. Surgery SFV. Peripheral Arterial Disease. In; 2018.
24. 中華醫學會外科學分會血管外科學組. 下肢動脈硬化閉塞癥診治指南. 中華普通外科學文獻(電子版) 2016;10:1-18.25. Gerhard-Herman MD, Gornik HL, Barrett C, et al. 2016 AHA/ACC Guideline on the Management of Patients With Lower Extremity Peripheral Artery Disease: Executive Summary A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. CIRCULATION 2017;135:E686-725.
26. Kullo IJ, Rooke TW. Peripheral Artery Disease. NEW ENGL J MED 2016;374:861-71.